
间充质干细胞(MSCs)由于其易于分离、多能性、免疫调节特性和可分泌支持组织重塑的介质等特性,因此在基于细胞的组织工程和再生医学方面具有巨大的治疗潜力[1,2]。MSCs和其他细胞一样,释放由细胞外囊泡(EVs)(凋亡小体、微囊泡和外泌体组成),通过与细胞膜融合进行细胞间的通信[3,4]。
外泌体是由核内体衍生而来的小的纳米级细胞外囊泡。它们是球形的,有一个脂质双层单膜,直径在50-200纳米之间。外泌体作为细胞间的信使,携带多种成分,包括反映其细胞来源的核酸、蛋白质、脂质和代谢物。这些成分维持着外泌体的潜在的治疗功能,模仿它们来自的细胞,并有助于发展无细胞治疗。此外,外泌体可以被设计为传递治疗药物的智能载体[2,5,6]。
GeneDireX公司于2008年在美国成立,已经在生物技术领域工作了10多年。由于我们的产品组合的扩大和生产重点的转移,我们现在位于台湾。我们的主要开发项目之一是细胞培养基。我们的细胞培养基是精心配制的,以支持多种细胞类型的生长和维持。我们提供各种基础培养基、特殊培养基、补充剂和定制配方的高质量材料和制造工艺,以满足细胞培养需求的具体要求。在这里,我们提供了两种不同的培养基,ADSC eXOrich和UCMSC eXOrich培养基,分别用于从人类脂肪来源的干细胞(ADSC)和脐带来源的间充质干细胞(UCMSC)中生产外泌体。这种外泌体生产培养基是一种无血清和即用型的培养基。该成分可优化提高外泌体的产量。
对于外泌体的纯化,我们建议从细胞培养后准备条件培养基开始。从培养细胞中收集上清液,通过超高速离心或离心过滤去除大块细胞碎片、细胞代谢产生的废物以及培养基中的杂质。随后,外泌体可以通过切向流过滤(TFF)进行浓缩,也可以通过体积排阻色谱(SEC)再次纯化。通过纳米颗粒跟踪分析(NTA)确定了通过上述方法获得的外泌体的直径,并通过蛋白质鉴定确定了外泌体的共同标记物的存在。
接下来,我们将分享我们在使用ADSC eXOrich和UCMSC eXOrich培养基生产外泌体方面的经验和结果。我们将使用NTA分析来确定颗粒的直径和浓度,并使用流式细胞术(FCM)结合细胞膜染料FM4-64,来检测和分析外泌体表面标记物: CD9、CD63和CD81。一般情况下,我们建议用户用在原培养条件下培养MSCs至汇合度达90%,然后去除原培养基,用PBS和eXOrich培养基清洗细胞,去除残留原培养基。然后用eXOrich培养基培养细胞3-4天,收集上清液。我们通过使用0.22um的滤杯离心和过滤去除细胞碎片和大碎片或颗粒,并使用TFF-Easy(HansaBioMed)浓缩外泌体。
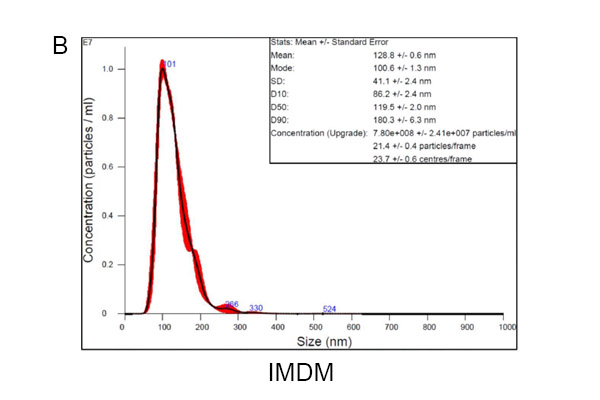
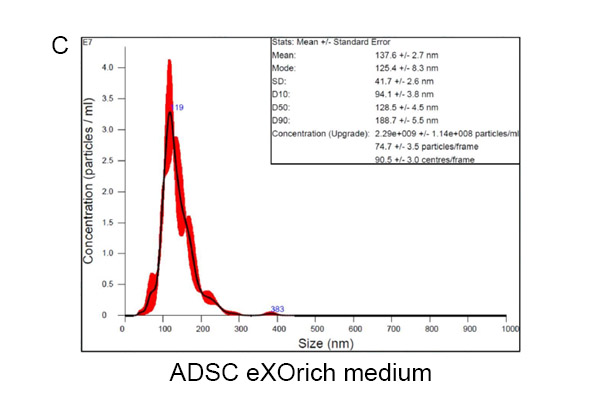
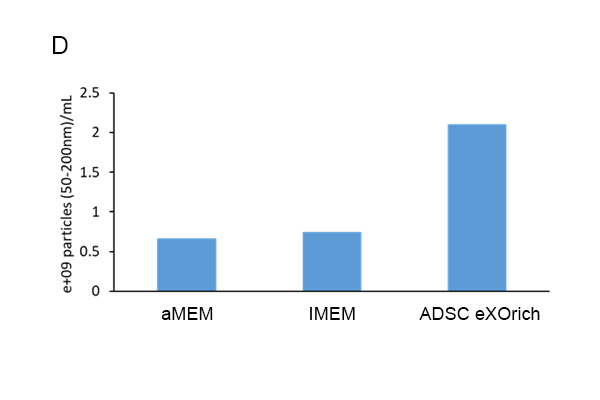
我们的结果显示,使用α-MEM(图1A)、IMDM(图1B)和ADSC ADSC培养基(图1C)培养获得的常见外泌体粒径分别为118.9±3.1、100.6±1.3和125.4±8.3。使用α-MEM、IMDM和ADSC eXOrich培养基的ADSCs分泌的外泌体(50-200 nm)的浓度(颗粒/mL)分别为6.63×10⁸±5.35×10⁷、7.37×10⁸±1.15×10⁷和2.11×10⁹±1.40×10⁸。ADSC eXOrich培养基比α-MEM或IMDM更能增加外泌体的产量(图1D)。
图1
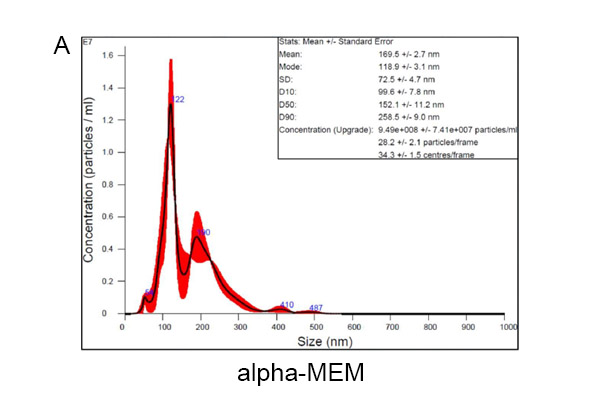
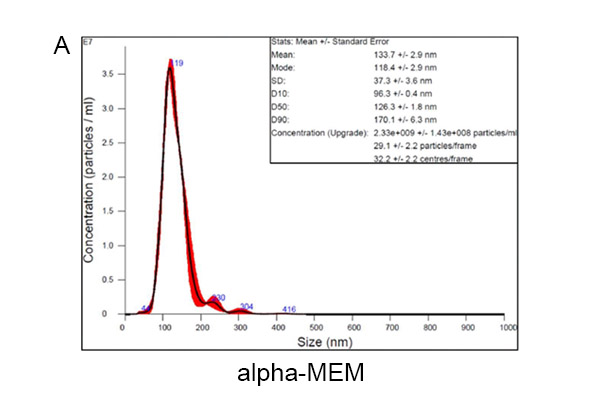
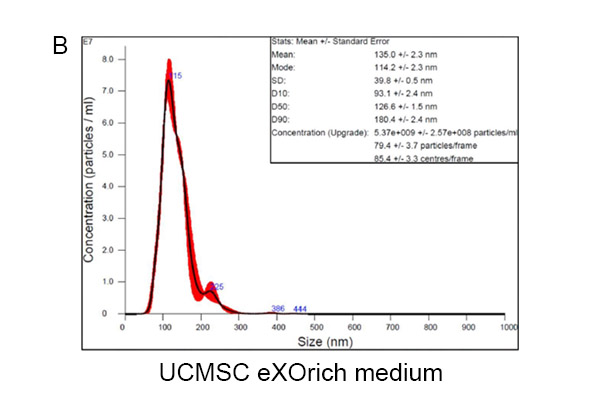
类似的实验数据可以重复使用另一种培养基,UCMSC eXOrich培养基。使用α-MEM培养基的UCMSC分泌外泌体直径为118.4±2.9 nm,外泌体浓度(50-200 nm)为2.22×10⁹±1.45×10⁸颗粒/mL(图2A)。使用UCMSC eXOrich培养基的UCMSC分泌外泌体直径为114.2±2.3 nm,浓度(50-200nm)为4.99×10⁹±2.85×10⁸颗粒/mL(图2B),高于α-MEM。
图2
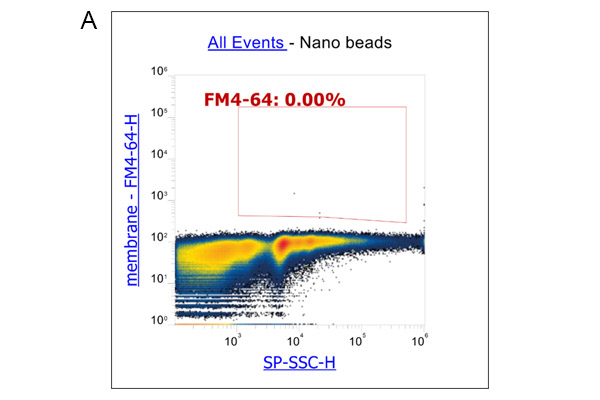
此外,我们还使用流式细胞术分析了外泌体表面标记物: CD9、CD63和CD81的表达。实验流程根据Pospichalova V等人的文章描述进行[7]。我们利用参考珠:NanoFCM™ Silica Nanospheres Cocktail #1,直径从68到155纳米,来设置光电倍增管的电压和光散射的阈值(图3A)。膜特异性、荧光两亲性苯乙烯基染料FM4-64被用于标记外泌体,因为外泌体具有脂质双层的单膜结构。为了获得更准确的数据,我们使用荧光减去一(FMO)对照来确定背景荧光和外泌体样本中阳性群体产生的荧光之间的cut-off值。对使用ADSC eXOrich培养培养的ADSC分泌的外泌体进行FCM分析FCM分析结果显示,在FM4-64染色后,一个升高的群体出现了荧光信号(图3B)。对该群体进行设门,分析CD9、CD63和CD81的表达。在这里,我们给出了CD63与CD9(图3C)和CD63与CD81的点图分析结果(图3D)。
图3
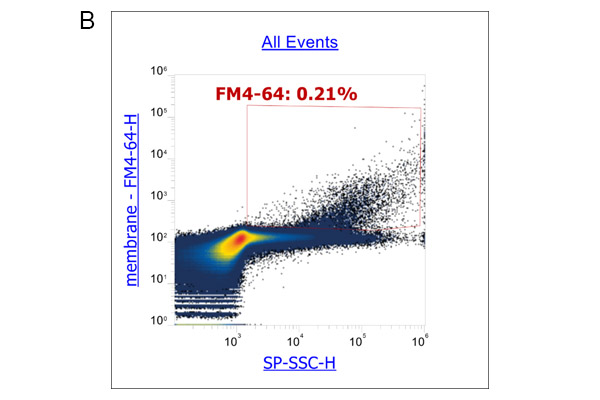
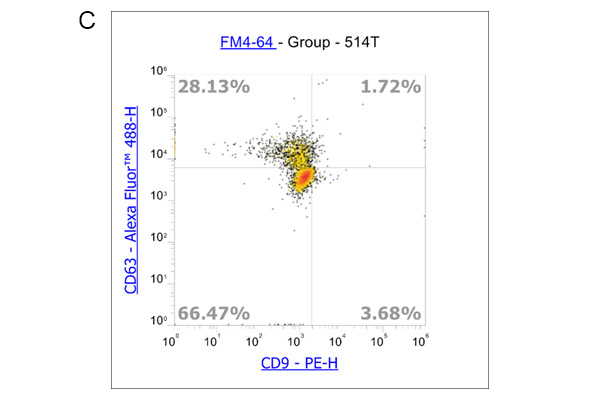
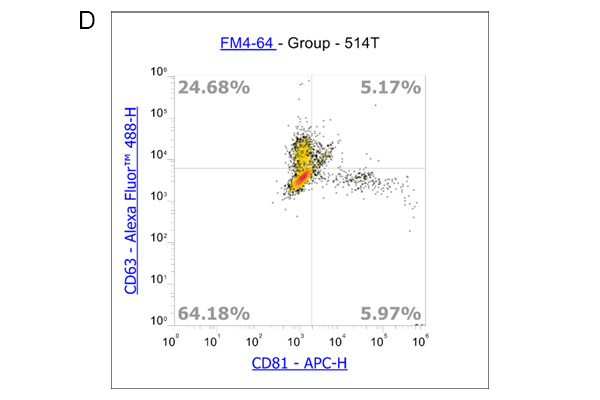
根据FCM分析数据,我们可以验证使用ADSC eXOrich培养基产生的外泌体是否表达CD9、CD63和CD81。为了总结FCM分析结果,我们鉴定了一群至少直径为68到155 nm的膜结构的粒子。这些颗粒含有CD9、CD63和CD81,它们被认为是外泌体标记物。
总之,结合NTA数据与FCM分析结果,我们的eXOrich培养基是高效且有利于从MSC中产生外泌体的。
|
产品货号 |
产品名称 |
规格 |
|
ADSC eXOrich Medium |
500 mL |
|
|
UCMSC eXOrich Medium |
500 mL |
#FormatH4ID_0#
#FormatH4ID_0#
#FormatH4ID_0#
#FormatH4ID_0#
#FormatH4ID_0#
#FormatH4ID_0#
Hong P, Yang H, Wu Y, Li K, Tang Z. The functions and clinical application potential of exosomes derived from adipose mesenchymal stem cells: a comprehensive review. Stem Cell Res Ther. 2019;10(1):242. Published 2019 Aug 7. doi:10.1186/s13287-019-1358-y
Zhang K, Cheng K. Stem cell-derived exosome versus stem cell therapy. Nat Rev Bioeng. Published online April 12, 2023. doi:10.1038/s44222-023-00064-2
Mulcahy LA, Pink RC, Carter DR. Routes and mechanisms of extracellular vesicle uptake. J Extracell Vesicles. 2014;3:10.3402/jev.v3.24641. Published 2014 Aug 4. doi:10.3402/jev.v3.24641
Ginini L, Billan S, Fridman E, Gil Z. Insight into Extracellular Vesicle-Cell Communication: From Cell Recognition to Intracellular Fate. Cells. 2022;11(9):1375. Published 2022 Apr 19. doi:10.3390/cells11091375
Rezaie J, Feghhi M, Etemadi T. A review on exosomes application in clinical trials: perspective, questions, and challenges. Cell Commun Signal. 2022;20(1):145. Published 2022 Sep 19. doi:10.1186/s12964-022-00959-4
Tan F, Li X, Wang Z, Li J, Shahzad K, Zheng J. Clinical applications of stem cell-derived exosomes. Signal Transduct Target Ther. 2024;9(1):17. Published 2024 Jan 12. doi:10.1038/s41392-023-01704-0
Pospichalova V, Svoboda J, Dave Z, et al. Simplified protocol for flow cytometry analysis of fluorescently labeled exosomes and microvesicles using dedicated flow cytometer. J Extracell Vesicles. 2015;4:25530. Published 2015 Mar 31. doi:10.3402/jev.v4.25530
#FormatH4ID_0#
#FormatH4ID_0#
Q1.我们如何产生外泌体?
答:对于外泌体的纯化,我们建议在细胞培养后开始准备条件培养基。从培养细胞中收集上清液,通过超高速离心或离心过滤去除大块细胞碎片、细胞代谢产生的废物以及培养基中的杂质。随后,外泌体可以通过切向流过滤(TFF)进行浓缩,也可以通过体积排阻色谱(SEC)再次纯化。
Q2.我们如何丰富外泌体的生产?
答:外泌体被称为细胞分泌的天然纳米囊泡,在传统培养条件下,MSC-条件培养基产生的外泌体产量低,从而限制了其应用。最佳的细胞培养基可以增强MSC的外泌体分泌。因此,我们开发了两种外泌体富集培养基。ADSC eXOrich培养基用于脂肪来源的干细胞分泌外泌体,UCMSC eXOrich培养基用于脐带间充质干细胞分泌外泌体。
Q3.需要这些补充剂吗?
答:一般来说,常用的补充剂,如血清或人血小板裂解液,都含有外泌体。因此,我们不建议在制备外泌体分离的条件培养基时使用补充剂。当使用ADSC eXOrich或UCMSC eXOrich培养基生产外泌体时,不需要添加常见的营养补充剂,如血清或人血小板裂解液。然而,用户可以根据自己的具体需要,决定添加适当的营养补充剂。
