
超111亿!2019年国家自然科学基金项目公布(面上项目)
导读
摘要:8月16日,2019年国家自然科学基金评审结果正式揭晓。2019年,国家自然科学基金委员会决定资助面上项目18995项,直接费用1112699万元,平均资助强度58.58万元/项,平均资助率18.98%。
8月16日,2019年国家自然科学基金评审结果正式揭晓。
国家自然科学基金委员会公布数据显示,今年项目申请集中接收期间共接收2364个依托单位提交的项目申请240711项,同比增加25844项,增幅12.03%。基金委发布的公告显示,决定资助41752项,共资助直接费用2103070.68万元,占全年资助计划的72.51%。
2019年,国家自然科学基金委员会决定资助面上项目18995项,直接费用1112699万元,平均资助强度58.58万元/项,平均资助率18.98%。
对高校而言,面上项目主要由高校从事科研活动的教授、副教授等青年教师获得,其立项数体现了各个高校中坚科研力量的多寡。
从统计结果来看,今年上海交通大学面上项目依然高居第一,总立项数高达618项,项目总金额达到3.52亿元。中山大学立项数高达494项,位居第二位,项目总金额达到2.82亿元。浙江大学共有496项,总金额共计2.72亿元。立项数前十的高校还有复旦大学(2.24亿)、华中科技大学(1.99亿)、北京大学(1.94亿)、同济大学(1.71亿)、中南大学(1.46亿)、山东大学(1.48亿)、清华大学(1.52亿)等高校。
该资迅素材整理于青塔网

加州出台美国首例“基因魔剪”法案:不要自行改变你的DNA
导读
近期,美国加利福尼亚州出台了一例针对CRISPR基因编辑技术的法案,该法案禁止在加利福尼亚州销售基因治疗工具包,除非卖家在显著位置警告消费者不要将工具包用在自己身上。提出上述法案的加利福尼亚州参议员Ling Ling Chang称,这是美国第一部直接监管CRISPR的法律。
法案规定,除非联邦法律允许,否则任何人不得在本州(加利福尼亚州)销售基因治疗工具包,除非卖方在其网站上的显眼位置(在销售之前向消费者展示)及基因治疗工具包的外包装上贴上清晰可见的标签,指出该工具包不能用于自我使用。这项法案于7月30日签署,将在2020年1月成为法律。
CRISPR是一种多功能的基因编辑技术,在很大程度上推进了基因研究。法案提到,CRISPR技术在易用性、有效性和成本方面相较其他基因编辑技术有很大改进;它在疾病调查、预防和治疗方面,有促成革命性进展的潜力。目前已有使用CRISPR技术治疗糖尿病、疟疾和镰状细胞病等疾病的重要研究。法案预计,到2025年,全球基因编辑市场将达到81亿美元。
2017年,美国食品药品监督管理局表示,以自我使用为目的而销售基因治疗产品是违法的,因为它们尚未获得批准。CRISPR技术的使用也受到了欧盟的监管。
加利福尼亚州的CRISPR法案主要针对业余爱好者将CRISPR技术使用在自己身上的行为。法案提到,当前市面上有一些在售的材料可供试验CRISPR技术,且以“自我使用”为名销售。这种现象使人们对消费者安全、公共卫生以及业余人士会使用CRISPR技术创造出什么而感到担忧。
法案称其意图是在不扼杀创新的情况下,确保消费者和公众的安全。“由于CRISPR技术尚处于起步阶段,特别是在公共消费领域,因此需要进行更多的研究以确保这些产品的安全。因此,适当地告知消费者,任何与CRISPR相关的基因治疗产品都不适用于自我使用”。
加利福尼亚州在基因编辑研究领域走在世界前沿,被广泛使用的基因编辑技术CRISPR-Cas9的共同发明人杜德纳(Jennifer Doudna)就来自加州大学伯克利分校。除此之外,据 《麻省理工科技评论》报道,加利福尼亚州出台这项法案还有一个具体原因。
《麻省理工科技评论》认为,这项法案直接针对一位叫做Josiah Zayner加利福尼亚州居民,他同时也是一个生物黑客。
2017年,Zayner拍摄了自行将CRISPR注射到手臂上的场景,并因此声名狼藉。Zayner对《麻省理工科技评论》表示,从2017年开始,他确实销售了一种针对人类基因的CRISPR产品,该产品可以编码一种叫做肌抑素的蛋白质的基因,用CRISPR去除这个基因可以使肌肉变大。但他说,该产品已在今年早些时候停产。
该资迅素材整理于基因谷

Car-T细胞治疗市场分析及未来发展趋势
导读
摘要:嵌合抗原受体T细胞(chimeric antigen receptor T cells,简称Car-T细胞)疗法是目前抗肿瘤免疫最火热的领域之一,也是近十年来免疫医学的重大突破。Car-T细胞治疗血液恶性肿瘤的效果令人瞩目,各大制药公司与创新型公司也纷纷抢占Car-T细胞治疗市场。Novartis与Gilead走在该领域的最前列,已有产品被美国FDA批准上市,Celgene与Merck等公司已有多种产品进入临床试验。
2017年8月,Novartis公司的CAR-T细胞Kymriah获美国FDA批准上市,用于治疗25岁以下急性淋巴细胞白血病(ALL)的复发或难治性患者,成为全球首个上市的自体细胞CAR-T疗法,是Car-T细胞疗法发展史的里程碑。两个月后,第二款CAR-T疗法Kite Pharma公司(被Gilead收购)开发的Yescarta也被批准上市,是首款获批用于治疗特定类型非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)的疗法。这两款Car-T细胞均是靶向CD19。
Car-T细胞的前世今生
Car-T细胞发展至今也并非一帆风顺,1987年,以色列科学家Zelig Eshhar首次提出嵌合抗原受体概念(chimeric antigen receptor,CAR);在1980年代,有科学家开始专注工程T细胞的研究;在1993年,第一代基于CD3-ζ链的Car-T细胞被发展出来。该Car-T细胞虽然具有激活T细胞的能力,但是只含有激活受体CD3-ζ,其抗肿瘤效果比较弱,不具备大规模杀灭肿瘤细胞的能力。
在第一代的基础上,科学家增加了一个共刺激受体结构域(包括CD28、 4-1BB、 DAP10等),在使用小鼠或人T细胞的几种模型中可以观察到具有双信号传导受体Car-T细胞的活性优于仅活化受体Car-T细胞的活性;2002年,基于CD28的第二代Car-T细胞出现;在2003年,科学家验证了CD19是优秀的CAR靶点,2004年,基于4-1BB的Car-T细胞被发展出来 。第三代Car-T细胞则是增加了多个共刺激受体结构域,进一步增强了Car-T细胞的活性。
对于第四代Car-T细胞来说,与前三代不同的是,在第二代的基础上增加了IL-12,被称为通用细胞因子介导杀伤的重定向T细胞(T cell redirected for universal cytokine-mediated killing,简称TRUCKs)。TRUCKs增强T细胞活化能力,吸引并激活先天免疫细胞,进而消灭抗原阴性癌细胞。TRUCKs还可以用于病毒感染、代谢病与自身免疫病等领域。不仅如此,TRUCKs还被用于难以攻克的固体瘤领域。若TRUCKs被发展成功,Car-T细胞的应用范围将大大扩展。


四代Car-T细胞的比较
然而,对目前来说,第三、四代Car-T细胞发展仍未完善,仍有诸多问题有待解决,第二代Car-T细胞对于血液恶性肿瘤具有很好的疗效,是Car-T领域的主流,并于2017年上市两款产品。
Car-T细胞靶点
目前,约有一半的Car-T细胞靶点均为CD19,CD19是一个优良的靶点,是一种特异性的B细胞质膜蛋白,参与PI3/AKT通路的调节,在B细胞的增殖与分化中起到很至关重要的作用。CD19在浆细胞中表达很少,却在B细胞的增殖过程中持续表达。而淋巴瘤与白血病正属于B细胞肿瘤。Celgene公司的JCAR017已进入临床试验II期用于治疗侵袭性B细胞非霍奇金淋巴瘤(NHL),以目前数据来看,JCAR017具有较高的安全性,其客观缓解率(ORR)为76%,完全缓解(CR)为39%。
在多发性骨髓瘤(MM)领域中,BCMA(B cell maturation antigen)受到青睐,几乎在所有的MM细胞表达,而不再正常细胞表达。Bluebird bio与Celgene研发的bb2121的靶点为BCMA,bb2121具有94% 的ORR;在复发性难治性多发性骨髓瘤(R/R MM)的严重预处理患者中,有56%属于CR。bb2121已被美国FDA授予突破性疗法。Celgene公司的另一款Car-T细胞JCARH125,已进入临床试验II期;Gilead 公司的KITE-585和Autolus公司的AUTO2也处于临床试验阶段。
而CD123在几乎所有血液系统恶性肿瘤中表达,包括急性髓性白血病(AML)。Mustang Bio 的MB-102与Cellectis公司的UCART123正处于临床试验I期,用于治疗复发性难治性急性髓性白血病(R/R AML)与囊性浆细胞样树突状细胞肿瘤(BPDCN)。
此外,还有基于CD20、CD33、EGFRvIII、HER2等靶点的Car-T细胞进入临床试验。而对于固体瘤来说,已有公司尝试利用Car-T细胞将mucin 16作为靶点,治疗卵巢癌。
Car-T细胞未来市场解析
Car-T细胞在血液恶性肿瘤中的应用有诱人的前景,在2026年,NHL与MM的全部市场空间将达到200亿美元,而Car-T细胞的市值也将达到11亿美元。届时,Car-T细胞有六大销售市场:美国、法国、德国、意大利、西班牙与英国。5大Car-T细胞产品称雄市场。在疾病领域,应用Car-T细胞治疗的当属多发性骨髓瘤,占据64%的份额;而非霍奇金淋巴瘤所占份额为32%,而白血病所占的份额仅为3%。
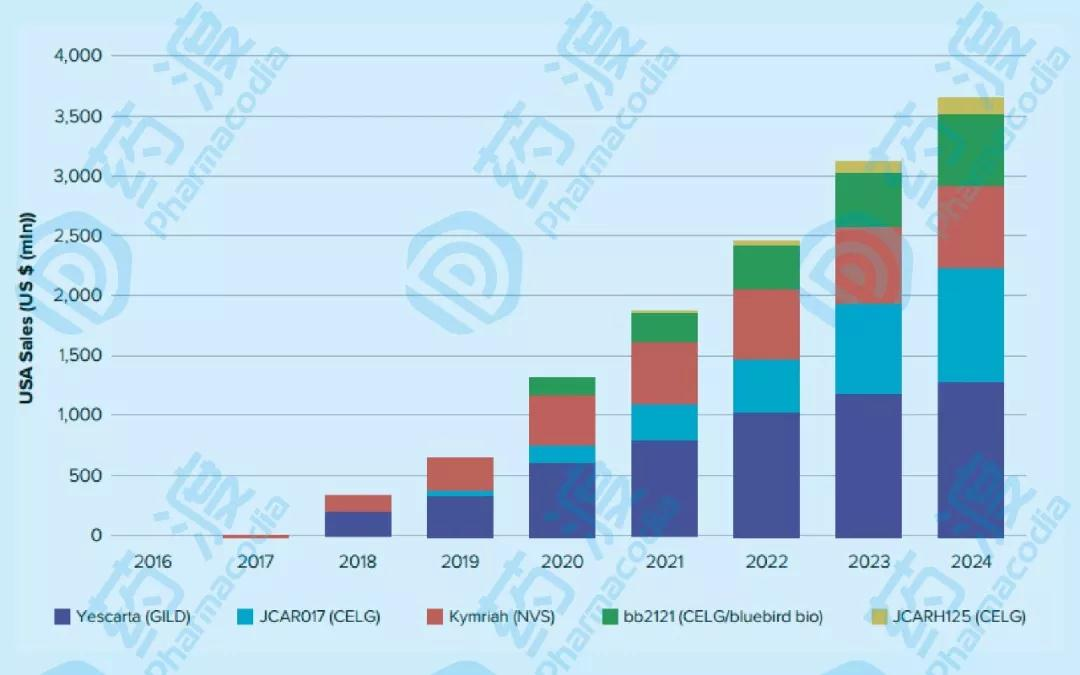
未来5年美国Car-T细胞产品销售额(来源:Evaluate pharma)
Car-T细胞疗法是当今最火热的免疫疗法之一,虽然它对血液恶性肿瘤具有很独特的效果,但是该疗法的缺点也很明显。Car-T细胞疗法目前针对的是血液肿瘤,对实体瘤仍然束手无策,而大多肿瘤却是实体瘤,好在第四代Car-T细胞疗法已有针对实体瘤的实验,但上市之路依然漫漫。而针对Car-T细胞需要回输患者T细胞操作非常费力且费用高,已有公司着手解决这件事情,上文提到的Cellectis利用异体的T细胞输入患者体内,不需要患者自身的T细胞,这就解决了Car-T细胞疗法的一个大问题,实现了Car-T细胞疗法,具有很广阔的应用前景。就此看来,Car-T细胞疗法虽然问题不断,但是随着科学家们不断创新,Car-T细胞疗法将越来越完善,治疗效果越来越好。
参考资料:
1.The market for chimeric antigen receptor T cell therapies.
2.The basic principles of chimeric antigen receptor (CAR) design.
3.Chimeric Antigen Receptor T-Cells (CART-Cells) for Cancer
Immunotherapy – Moving Target for Industry?
4.CAR T-cell Therapy:A New Era in Cancer Immunotherapy.
5.Evaluate Epi Analyzer
该资讯素材整理于药渡网


