
摘要:免疫组织化学用于研究组织中蛋白质的定位。通过带有显色剂或荧光标记的抗体对抗原的特异性结合,可以实现组织中蛋白质的可视化,从而对组织和细胞中的蛋白质进行定性,定位,定量等分析。免疫组化通常分为一步法和两步法。在一步法中,特异性抗体上直接带有显色剂或荧光基团。在更广泛使用的二步法中,被固定和通透化的组织首先与一抗混合。在一抗特异性结合目标蛋白后,加入带有显色剂或荧光基团的二抗特异性结合一抗,使目标蛋白可以在显微镜下被观察到。
本方案以果蝇卵巢为例,结合绿色荧光蛋白对两种蛋白同时进行免疫荧光染色,用聚光扫描共聚焦显微镜同时进行四通道扫描,从而达到对三种蛋白以及DNA在细胞中的分布进行同步分析。
材料与试剂
1)培养皿
2)载玻片
3)盖玻片
4)雌性果蝇成虫
5)Grace’s Insect Medium
6)4%多聚甲醛 (paraformaldehyde, PFA)
7)PBS (10×) (Beyotime, ST476)
8)Triton X-100
9)马血清
10)一抗 (特异性结合目标蛋白)
兔抗c-Myc
山羊抗CTP合成酶 (CTP synthase, CTPS)
11)二抗 (带有荧光基团,特异性结合一抗)
Texas Red狗抗山羊IgG
Cy5狗抗兔IgG
12)DNA荧光染料: Hoechst 33342
13)凡士林
14)指甲油
15)磷酸缓冲液 (1× PBS) (见溶液配方)
16)PST (1×) (见溶液配方)
仪器设备
1) 镊子
2) 解剖显微镜 (OLYMPU SZ61)
3) 移液器
4) 激光扫描共聚焦荧光显微镜 (Leica SP5II或者SP8)
5) 果蝇二氧化碳麻醉工作站
实验步骤
一、 组织解剖和固定
1. 在饲养果蝇的容器中通入二氧化碳使果蝇麻醉,将果蝇倒出,置于表面通有二氧化碳的垫板上,挑选雌性果蝇。
2. 在培养皿中倒入Grace’s Insect Medium,将果蝇置于液体中。用镊子轻轻固定住果蝇腹部的前部,用另一把镊子夹住果蝇腹部的倒数第二个体节,并将这部分从果蝇身体上扯下,卵巢会被一起扯出 (图1)。尽快将卵巢转移至新的培养皿中,卵巢上附着的组织将会在后续步骤中被清除。
注:1) 解剖和固定在室温下进行,试剂应在从冰箱拿出后放至室温后再使用。2) 可使用移液器进行转移,在转移之前剪去移液管顶部的一部分使其能吸入卵巢大小的组织。如果组织容易粘在管壁上,可以先在新的培养皿中滴入一滴Grace’s Insect Medium,将镊子夹在组织不易破损或者对于实验不重要的部分,轻轻夹起组织,置于新培养皿的液滴中,放下组织。
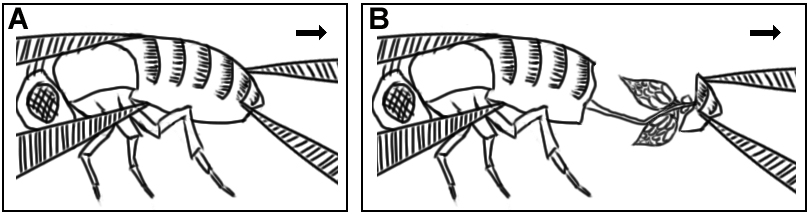
图1. 解剖果蝇卵巢示意图.
A. 用镊子轻轻固定住果蝇腹部的前部,用另一把镊子夹住果蝇腹部的倒数第二个体节。B. 左手镊子固定果蝇身体,右手镊子将果蝇尾部两个体节轻轻拉出,卵巢会被一起扯出。这时不必对解剖组织进行清理,迅速开始解剖下一只果蝇。左撇子的拿镊子解剖方式与此呈镜像对称。
3. 使用移液器尽可能多的移去组织周围的Grace’s Insect Medium。
4. 使用移液器在组织上滴加200 μl 4% PFA,使组织浸没在液滴中。在室温下静置固定10分钟。
5. 使用移液器尽可能多的移去卵巢周围的PFA。
6. 加入2 ml PBS,轻轻摇晃培养皿,洗去残留的PFA,移去PBS。一次即可。
7. 加入PST,在解剖显微镜下去除卵巢周围附着的其他组织。
8. 将卵巢使用移液器转移至600 μl离心管中,加入400 μl PST,储存于4 °C或立即用于接下来的实验。
注:根据组织和固定情况的不同,组织的有效的保存时间会有较大差异。为了取得最佳的染色效果,尽量使用新鲜制备的样品。
二、 免疫组化染色
1. 使用PST稀释抗体原液,按比例配制20 μl体积的一抗溶液,使得一抗最终稀释比例在1:200至1:1,000之间,或者是抗体终浓度为1 μg/ml。
注:在本示例中一抗 (兔抗c-Myc,山羊抗CTPS) 的稀释比例为1:200,一抗的浓度应根据具体情况进行调整。
2. 将两对固定好的卵巢使用移液器转移至新的600 μl离心管中。
注:卵巢属于相对较大的组织,一般在20 μl的抗体溶液中加入2对卵巢。在抗体浓度相同的情况下,样品越少染色效果越好。
3. 使用移液器尽可能多的移去卵巢周围的液体。
4. 加入20 μl一抗溶液。
5. 室温孵育过夜。
注:一抗最佳孵育时间与温度和样品的情况有关,一般一抗孵育不超过一天。
6. 使用PST稀释并配制二抗溶液,使得二抗最终稀释比例在1:200至1:1,000之间。加入DNA染料 (DAPI或Hoechst,稀释比例1:1,000),总体积为20 μl。
注:本示例中二抗 (Texas Red狗抗山羊IgG; Cy5狗抗兔IgG)的稀释比例为1:250,Hoechst 33342的终浓度为1 μg/ml。二抗和DNA染料的浓度应根据具体情况进行调整。
7. 使用移液器尽可能多的移去卵巢周围的一抗溶液。
8. 使用移液器加入200 μl PST,轻轻吹打,洗去残留的一抗,移去PST。
注:如果样品成像时背景信号较强,可多次重复这一步。
9. 加入20 μl二抗溶液。
10. 室温孵育过夜。
注:1) 二抗最佳孵育时间与温度和样品的情况有关,如果样品成像时信号较弱,可以选择延长二抗孵育时间至两天或更长。2)如需储存,可以在二抗孵育过夜后将样品继续放在二抗溶液中在4 °C保存。保存时间过长会导致较强的背景信号。
三、 制片与成像
1. 在纸巾上放置一片盖玻片。
2. 在盖玻片的四角涂上凡士林
3. 使用移液器将卵巢和15 μl左右的二抗溶液一起转移至盖玻片上。
注:在二抗溶液浓度合理的情况下,不需要洗去二抗。
4. 将载玻片轻压在盖玻片上,使盖玻片通过凡士林粘在载玻片上,翻转载玻片,使盖玻片在上,置于纸巾上。
5. 使用移液管轻压盖玻片的四角,使四角的高度尽量相同,赶出载玻片和盖玻片之间的气泡。
6. 如有液体溢出,轻轻用纸巾吸去。
7. 使用指甲油密封盖玻片的四边。
8. 待指甲油晾干后,可使用荧光显微镜或共聚焦荧光显微镜进行成像。
注:在制片完成后应尽快进行成像。如果无法及时进行成像,应如免疫组化染色 (8) 中所述保存在二抗溶液中,在成像之前再取出制片。
结果与分析
核苷酸CTP的从头合成的限速反应由CTPS催化。我们之前的工作表明,CTPS在果蝇卵巢里的细胞以及其他组织中可以形成蛇形的细胞内结构,我们把这种结构称为细胞蛇 (英文单数是cytoophidium;复数是Cytoophidia) (Liu, 2010)。
在寻找CTPS组装成细胞蛇的因子研究中,我们发现原癌基因Myc表达量对细胞蛇的形成有影响。因此,我们利用果蝇遗传手段,以果蝇卵巢中的单层上皮细胞滤泡细胞作为研究模型。细胞核中的GFP表明该细胞中Myc会因为RNA干扰而表达水平降低。对此,我们在解剖果蝇获得卵巢,并进行固定之后,同时用两种一抗 (兔抗c-Myc,山羊抗CTPS) 与样品孵育,室温过夜。
第二天把一抗用PST溶液清洗一遍。然后向装有样品的小管中同时加两种二抗 (Texas Red狗抗山羊IgG; Cy5狗抗兔IgG),并且加入DNA荧光染料Hoechst 33342,孵育,室温过夜。次日可以制片用激光扫描共聚焦显微镜拍照。
由于我们所用的四个不同染料 (Hoechst 33342,GFP,Texas Red和Cy5) 的激发光和收集光光谱均有不同,这样我们可以在激光扫描显微镜下开通四个通道,同时检测DNA和三种蛋白质 (GFP,CTPS和Myc) (图2)。这样我们就可以清晰并且直接的观察到,在Myc被敲低的细胞里 (GFP阳性),Myc的免疫染色几乎没有 (图2D)。与之对比的是对照细胞 (GFP阴性) 里Myc免疫染色信号在细胞核里很明显 (图2D)。对应的是,Myc蛋白水平高的细胞 (GFP阴性) 里CTPS可以形成纤维状细胞蛇 (图2C),而Myc蛋白水平低的细胞 (GFP阳性) 里则看不到CTPS组成的细胞蛇(图2C)。这种多组分相互关系可以用不同色彩在叠加图中展示 (图2E)。因此,这个免疫组织化学的结果支持Myc对CTPS组装成细胞蛇有调控作用 (Auguey等,2016)。
溶液配方
1) 磷酸缓冲液 (1× PBS)
使用去离子水稀释PBS (10×) 至1×
2) PST (1×)
1× PBS
0.3% Triton X-100
0.5%马血清
致谢
刘冀珑实验室的工作得到上海科技大学,英国牛津大学以及英国医学理事会的支持。本文实验方案改编自本实验室的发表文章Tastan和Liu (2015) 和Aughey等 (2016).
参考文献
Copyright: © 2019 The Authors; exclusive licensee Bio-protocol LLC.
引用格式:吴铮 , 刘冀珑 . (2019). 果蝇组织免疫组织化学. Bio-101: e1010256. DOI: 10.21769/BioProtoc.1010256.
How to cite: Wu, Z. and Liu, J. L. (2019). Immunohistochemistry of Drosophila Tissues. Bio-101: e1010256. DOI: 10.21769/BioProtoc.1010256.
