
免疫组织化学 (Immunohistochemistry,IHC) 或免疫细胞化学(Immunocytochemistry, ICC) 是利用抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂显色来确定组织细胞内抗原(多肽和蛋白质),对组织切片或细胞标本中的某些多肽和蛋白质等大分子物质进行原位定性、定位或定量研究的实验技术。
标本固定
固定(Fixation)是使用化学试剂处理组织或细胞,的目的除了使细胞内的蛋白质凝固,减少或终止内源性或外源性细胞内分解酶的反应,防止组织细胞自溶,更是为了保存组织或细胞内的抗原性,使抗原不失活,不发生弥散。较好的固定剂具有渗透性强;其次不能使组织发生过度收缩变形;还需使组织得到一定的硬度,有较好的折光度。
固定剂多种多样,例如无水酒精对糖原保存较好,容易使细胞收缩,其性能与95%酒精相似,很少单独使用,一般只用于糖原的固定不同的抗原对固定液耐受程度不同。丙酮为易挥发的无色液体,有刺激性气体。可使蛋白质沉淀,渗透性强,细胞收缩严重,对核的固定差广泛用于酶组织化学中的各种酶的固定,也有人用于抗原的保存,作为细胞涂片免疫组化的固定液。
此外,有些固定剂对特殊组织有更好效果,如苦味酸对于头皮、指甲固定有软化效果,戊二醛(含有两个醛基,具有很强的交联作用)常用于电镜标本的固定,使用浓度为2.5%,PLP固定液(Periodate-lysine-paraformaldehyde,由过碘酸、赖氨酸和多聚甲醛混合组成的磷酸盐缓冲液)对于含糖组织抗原保存更好。如上所述我们需要根据实际情况选择合适的固定剂。
目前常用的固定剂有中性甲醛液(甲醛饱和水溶液称为福尔马林),4%多聚甲醛-磷酸盐缓冲液。多聚甲醛固定效果温和,广泛应用于免疫组织化学研究。甲醛能够以固体的形式存在,即白色粉末状的多聚甲醛。将多聚甲醛溶于PB,加热至60℃(加热可使多聚甲醛解聚为单体,必要时可滴加少量NaOH促进其溶解),加热搅拌至液体透明为止。
固定方法多种多样,常用的有浸透法、灌注法、原位法、滴片法、蒸汽法、微波法等,其中以浸透固定和灌注固定效果最好。灌注固定中将灌注针插入主动脉内是灌注固定的关键,也是难点。首先准确找到主动脉,这是此步骤的要点。可用温生理盐水将胸腔内的血液冲洗干净,用眼科镊子轻轻夹住心 外膜(夹的越少越好,以免影响取材)将心脏向左上方提起,即可看清主动脉,又可使灌注针很容易地插入主动脉内。插入时动作要慢,针尖方向不要偏向右侧,以免刺入右心房,如果感到有阻力,则将针退后、调整方向重新进针,直到进入主动脉,灌注针进入主动脉后可在心脏的上方看到其位置,灌注针进入主动脉的长度最好为3-5毫米。
脱水、石蜡包埋和制片
脱水是指使用脱水剂置换组织中的水分使标本内处于无水状态,具体是用梯度乙醇(由低到高)充分脱水,对于一些易脆的组织(如脾、肝脏等)应减少高浓度酒精里的停留时间,透明的时间也应该控制缩短。
对组织浸蜡时,一般选用56℃-58℃熔点的石蜡,石蜡液与标本的比例应该为(20-30):1,浸蜡温度最好不超过60℃,防止抗原的损失。
包埋是指将已浸透石蜡的组织块置入包埋模具内,包埋应选好角度动作迅速,以便切片时有完整的切面。切片时则要该快则快该慢则慢,及时检查刀片是否出现缺口,最好使用新刀片以防止蜡带出现划痕。包埋后需要快速冷却,使标本与石蜡在短时间内凝聚成密度一致的一个整体。
脱蜡和水化
切片分别在二甲苯中10-15分钟以脱掉组织中的石蜡,使组织恢复到固定后的正常状态暴露出抗原以方便与一抗结合。若脱蜡和水化不全易出现局灶性反应和浸洗不全,而产生非特异性背景着色。脱蜡的效果主要是取决于切片的厚度、二甲苯的温度、脱蜡时间,或移入恒温箱加热脱蜡。
水化的目的是为了洗去溶解的石蜡和二甲苯。二甲苯属于非水溶液的有机溶剂,进入组织中的二甲苯不能与水溶性染色液相溶,需要通过梯度乙醇把组织中的二甲苯逐步替换出来,使标本切片从无水状态顺利进入染色液中进行染色反应。
抗原修复
抗原修复是指暴露抗原被封闭或隐藏的表位,恢复其原有的空间状态,提高抗原阳性检出率的过程。由于组织在甲醛或多聚甲醛固定过程中,发生了蛋白之间交联及醛基的封闭作用,从而掩盖抗原决定通过抗原修复,使得细胞内抗原决定族重新暴露,提高抗原检测率。
常用的修复方法从强到弱一般分为三种,高压加热修复、微波修复、胰酶修复。其中高压加热修复这一方法简便易操作,效果也更好。
胰酶消化修复法主要用于细胞内的抗原修复。使用0.1%氯化钙(pH 7.6)制成0.05%-0.1%胰酶液,37℃孵育切片15-30分钟,陈片应当适当延长时间。
使用高压加热修复对于修复温度(92-98℃以上)和时间的把握十分重要,温度越高修复时间越短,温度与修复时间呈负相关。修复结束后注意室温冷却,让蛋白自然复性。其次,尽量使用过量的抗原修复液,防止高温液体挥发干涸,对切片造成不可逆的损伤。
灭活内源性过氧化物酶和生物素
在传统的亲和素-生物素-过氧化物酶复合物法(ABC法)和链霉亲和素-过氧化物酶法(SP法)中,免疫组化反应容易受到内源性过氧化物酶和生物素的干扰,必须用过氧化氢和卵白素等进行灭活和封闭。灭活内源性过氧化物酶一般用3%过氧化氢灭活约10分钟左右,用甲醇配制过氧化氢更适合于保护抗原和固定组织。
血清封闭
目的为了防止一抗与组织的非特异性结合,造成假阳性。
切片清洗
PBS洗涤是为了去除未反应的抗体和其他杂物,以减少非特异性反应引起的背景着色和杂物污染,因此应该充分洗涤,特别是一抗孵育后。一般使用PBS洗涤3次,每次5分钟。
DAB显色
DAB显色液(3,3’-二氨基联苯胺)终产物为棕黄色或棕褐色,为免疫组化最常见的的显色液。DAB显色的棕黄色色原稳定性好,不溶于有机溶剂,可长期保存而不褪色。背景的深浅和特异性染色的深浅都可以由DAB孵育条件决定。DAB显色时间不是固定的,主要由显微镜下控制显色时间,到出现特异性染色较强而背景着色较浅时即可冲洗。
DAB显色时间很短(如几秒或几十秒)就立即出现很深的棕褐色,这可能说明一抗浓度过高,需要适当下调抗体浓度;若很短时间就出现深背景,有可能非特异性蛋白封闭不全,需要延长封闭时间;DAB显色时间很长(如超过10分钟)才出现阳性染色,可能是一抗体浓度过低或者封闭时间过长。贴片后梯度酒精脱水透明中性树脂封片后拍片即可。
常见问题与解决方案
缺乏染色
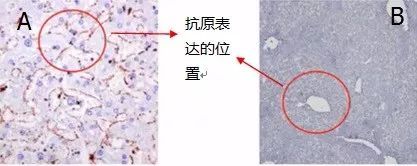
下图样本是正常人肝血管组织,目标蛋白是α-平滑机动蛋白,A图是我们想得到的结果,B图是做出来的实验结果,与A图相比,在红圈处并没有检测到抗原。

高背景
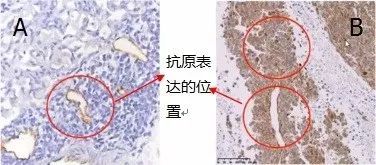
下图样本是小鼠皮下移植瘤组织,目标蛋白LYVE1,A图是我们想得到的结果,B图是做出来的实验结果,与A图相比,B图背景高。

染色不正确
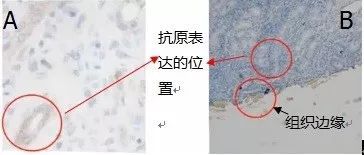
下图样本是人小肠粘膜组织,目标蛋白IL-10,A图是我们想得到的结果,B图是做出来的实验结果,在与A图相同位置的B图中没有检测到抗原,反而在组织边缘检测到组织表达。

整理自网络
